Серная кислота ЧДА
Серная кислота техническая
МЕЖДУНАРОДНОЕ НАЗВАНИЕSulfuric acid
СИНОНИМЫ НАЗВАНИЙ
Купоросное масло
ВНЕШНИЙ ВИД
Серная кислота – маслянистая жидкость. Она бесцветна и тяжела, отличается крайней гигроскопичностью.
ФОРМУЛА
H₂SO₄
ГОСТ, ТУ
ГОСТ 2184-2013
КВАЛИФИКАЦИЯ (МАРКА, СОРТ)
Техническая
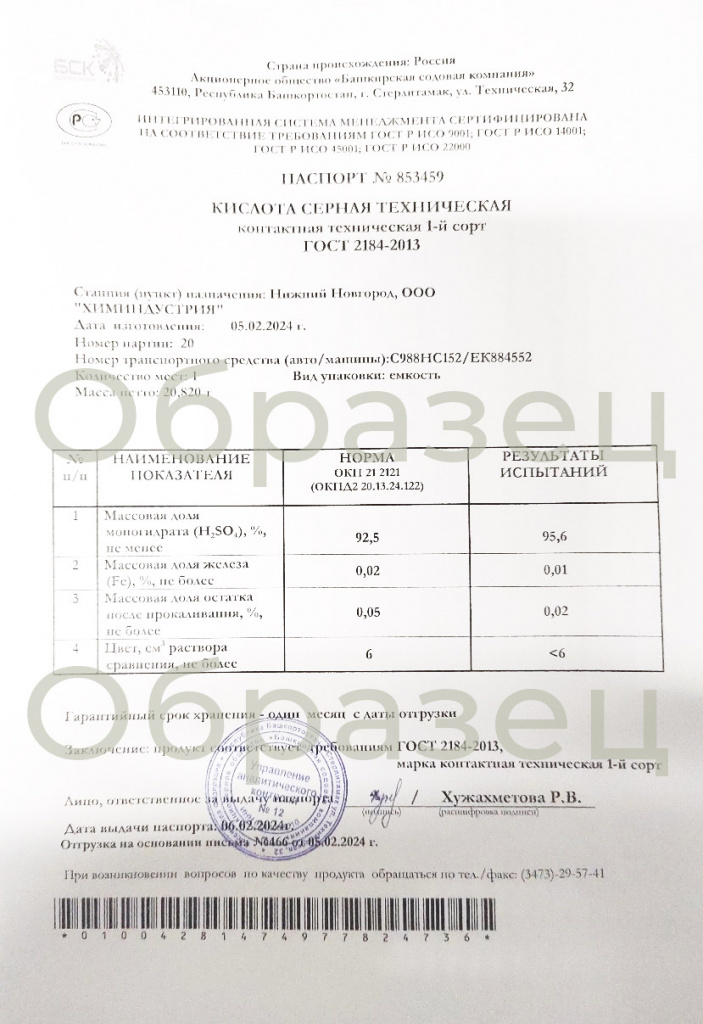
ПАСПОРТ КАЧЕСТВА
КОД ТН ВЭД
2807 00 000 1
УПАКОВКА
Химически чистую кислоту упаковывают в кварцевые или стеклянные ёмкости в зависимости от марки кислоты.
Техническую серную кислоту 1-го и 2-го сортов, башенную и регенерированную кислоты транспортируют в железнодорожных сернокислотных цистернах, а также в стальных контейнерах, стальных бочках по ГОСТ 6247 или поставляют потребителю перекачкой по кислотопроводу из стали марки Ст3 по ГОСТ 380.
В качестве транспортной тары особо чистой кислоты используют обрешётки из полимерных материалов.
Аккумуляторную кислоту транспортируют в ж/д цистернах, предназначенных для H2SO4, а также в стеклянных бутылках. Допускается перевозка автотранспортом.
Марка К транспортируется в цистернах из кислостойкой стали СтЗ с установкой фторопластовой прокладки или другого коррозиестойкого материала по отношению к кислоте.

КЛАСС ОПАСНОСТИ ГРУЗА ПО ДОПОГ(ООН)
8
ХИМИЧЕСКИЕ СВОЙСТВА
Серная кислота в чистом виде (формула H2SO4), при концентрации 100% представляет собой бесцветную густую жидкость. Самое важное свойство H2SO4 заключается в высокой гигроскопичности – это способность отнимать из воздуха воду. Данный процесс сопровождается масштабным выделением тепла.
H2SO4 – это сильная кислота.
Серная кислота называется моногидратом – в ней на 1 моль SO3 приходится 1 моль Н2О (воды). Из-за ее внушительных гигроскопических свойств ее используют для извлечения влаги из газов.
Температура кипения – 330 °С. При этом происходит разложение кислоты на SO3 и воду. Плотность – 1,84. Температура плавления – 10,3 °С/.
Концентрированная серная кислота представляет собой мощный окислитель. Чтобы запустить окислительно-восстановительную реакцию кислоту требуется нагреть. Итог реакции – SO2. S+2H2SO4=3SO2+2H2O
В зависимости от концентрации серная кислота по-разному вступает в реакцию с металлами. В разбавленном состоянии серная кислота способна окислять все металлы, которые стоят в ряду напряжений до водорода. Исключение составляют платина и золото как самые стойкие к окислению. Разбавленная серная кислота взаимодействует с солями, основаниями, амфотерными и основными оксидами. Серная кислота концентрированная способна окислять все металлы, стоящие в ряду напряжений, причем серебро тоже.
Серная кислота образует два вида солей: кислые (это гидросульфаты) и средние (сульфаты)
H2SO4 вступает в активную реакцию с органическими веществами и неметаллами, причем некоторые из них она способна превратить в уголь.
Серный ангидрит отлично растворяется в H2SО4, и при этом образуется олеум – раствор SО3 в серной кислоте. Внешне это выглядит так: дымящаяся серная кислота, выделяющая серный ангидрит.
Серная кислота в водных растворах является сильной двухосновной, и при добавлении ее к воде выделяется огромное количество теплоты. Когда готовят разбавленные растворы H2SО4 из концентрированных, необходимо небольшой струйкой добавлять более тяжелую кислоту к воде, а не наоборот. Это делается во избежание вскипания воды и разбрызгивания кислоты.
ПРИМЕНЕНИЕ
Техническая серная кислота предназначается для производства удобрений, искусственного волокна, капролактама, двуокиси титана, этилового спирта, анилиновых красителей и целого ряда других производств.
Серную кислоту применяют:
- в производстве минеральных удобрений;
- как электролит в свинцовых аккумуляторах;
- для получения различных минеральных кислот и солей;
- в производстве химических волокон, красителей, дымообразующих веществ и взрывчатых веществ;
- в нефтяной, металлообрабатывающей, текстильной, кожевенной и др. отраслях промышленности;
- в пищевой промышленности – зарегистрирована в качестве пищевой добавки E513 (эмульгатор);
- в промышленном органическом синтезе в реакциях: дегидратации (получение диэтилового эфира, сложных эфиров);
- гидратации (этанол из этилена);
- сульфирования (синтетические моющие средства и промежуточные продукты в производстве красителей);
- алкилирования (получение изооктана, полиэтиленгликоля, капролактама) и др.
Химически чистая кислота применяется для производства продукции специальной и тонкой химии.
Особо чистая кислота применяется для производства высокотехнологичных продуктов и аналитических материалов.
Аккумуляторная кислота применяется для производства электролита в свинцовых аккумуляторных батареях.
Марка К применяется для производства продукции промышленной и специальной химии.
УСЛОВИЯ ПОСТАВКИ
Продажа оптом с доставкой по всей России
Уточнить стоимость
Серная кислота ХЧ
МЕЖДУНАРОДНОЕ НАЗВАНИЕSulfuric acid
СИНОНИМЫ НАЗВАНИЙ
Купоросное масло
ВНЕШНИЙ ВИД
Серная кислота – маслянистая жидкость. Она бесцветна и тяжела, отличается крайней гигроскопичностью.
ФОРМУЛА
H₂SO₄
ГОСТ, ТУ
ГОСТ 4204-77 (СТ СЭВ 3856-82)
КВАЛИФИКАЦИЯ (МАРКА, СОРТ)
Химически чистая
КОД ТН ВЭД
2807 00 000 1
УПАКОВКА
Химически чистую кислоту упаковывают в кварцевые или стеклянные ёмкости в зависимости от марки кислоты.
Техническую серную кислоту 1-го и 2-го сортов, башенную и регенерированную кислоты транспортируют в железнодорожных сернокислотных цистернах, а также в стальных контейнерах, стальных бочках по ГОСТ 6247 или поставляют потребителю перекачкой по кислотопроводу из стали марки Ст3 по ГОСТ 380.
В качестве транспортной тары особо чистой кислоты используют обрешётки из полимерных материалов.
Аккумуляторную кислоту транспортируют в ж/д цистернах, предназначенных для H2SO4, а также в стеклянных бутылках. Допускается перевозка автотранспортом.
Марка К транспортируется в цистернах из кислостойкой стали СтЗ с установкой фторопластовой прокладки или другого коррозиестойкого материала по отношению к кислоте.
КЛАСС ОПАСНОСТИ ГРУЗА ПО ДОПОГ(ООН)
8
ХИМИЧЕСКИЕ СВОЙСТВА
Серная кислота в чистом виде (формула H2SO4), при концентрации 100% представляет собой бесцветную густую жидкость. Самое важное свойство H2SO4 заключается в высокой гигроскопичности – это способность отнимать из воздуха воду. Данный процесс сопровождается масштабным выделением тепла.
H2SO4 – это сильная кислота.
Серная кислота называется моногидратом – в ней на 1 моль SO3 приходится 1 моль Н2О (воды). Из-за ее внушительных гигроскопических свойств ее используют для извлечения влаги из газов.
Температура кипения – 330 °С. При этом происходит разложение кислоты на SO3 и воду. Плотность – 1,84. Температура плавления – 10,3 °С/.
Концентрированная серная кислота представляет собой мощный окислитель. Чтобы запустить окислительно-восстановительную реакцию кислоту требуется нагреть. Итог реакции – SO2. S+2H2SO4=3SO2+2H2O
В зависимости от концентрации серная кислота по-разному вступает в реакцию с металлами. В разбавленном состоянии серная кислота способна окислять все металлы, которые стоят в ряду напряжений до водорода. Исключение составляют платина и золото как самые стойкие к окислению. Разбавленная серная кислота взаимодействует с солями, основаниями, амфотерными и основными оксидами. Серная кислота концентрированная способна окислять все металлы, стоящие в ряду напряжений, причем серебро тоже.
Серная кислота образует два вида солей: кислые (это гидросульфаты) и средние (сульфаты)
H2SO4 вступает в активную реакцию с органическими веществами и неметаллами, причем некоторые из них она способна превратить в уголь.
Серный ангидрит отлично растворяется в H2SО4, и при этом образуется олеум – раствор SО3 в серной кислоте. Внешне это выглядит так: дымящаяся серная кислота, выделяющая серный ангидрит.
Серная кислота в водных растворах является сильной двухосновной, и при добавлении ее к воде выделяется огромное количество теплоты. Когда готовят разбавленные растворы H2SО4 из концентрированных, необходимо небольшой струйкой добавлять более тяжелую кислоту к воде, а не наоборот. Это делается во избежание вскипания воды и разбрызгивания кислоты.
ПРИМЕНЕНИЕ
Техническая серная кислота предназначается для производства удобрений, искусственного волокна, капролактама, двуокиси титана, этилового спирта, анилиновых красителей и целого ряда других производств.
Серную кислоту применяют:
- в производстве минеральных удобрений;
- как электролит в свинцовых аккумуляторах;
- для получения различных минеральных кислот и солей;
- в производстве химических волокон, красителей, дымообразующих веществ и взрывчатых веществ;
- в нефтяной, металлообрабатывающей, текстильной, кожевенной и др. отраслях промышленности;
- в пищевой промышленности – зарегистрирована в качестве пищевой добавки E513 (эмульгатор);
- в промышленном органическом синтезе в реакциях: дегидратации (получение диэтилового эфира, сложных эфиров);
- гидратации (этанол из этилена);
- сульфирования (синтетические моющие средства и промежуточные продукты в производстве красителей);
- алкилирования (получение изооктана, полиэтиленгликоля, капролактама) и др.
Химически чистая кислота применяется для производства продукции специальной и тонкой химии.
Особо чистая кислота применяется для производства высокотехнологичных продуктов и аналитических материалов.
Аккумуляторная кислота применяется для производства электролита в свинцовых аккумуляторных батареях.
Марка К применяется для производства продукции промышленной и специальной химии.
УСЛОВИЯ ПОСТАВКИ
Продажа оптом с доставкой по всей России
Уточнить стоимость
Серная кислота ЧДА
МЕЖДУНАРОДНОЕ НАЗВАНИЕSulfuric acid
СИНОНИМЫ НАЗВАНИЙ
Купоросное масло
ВНЕШНИЙ ВИД
Серная кислота – маслянистая жидкость. Она бесцветна и тяжела, отличается крайней гигроскопичностью.
ФОРМУЛА
H₂SO₄
ГОСТ, ТУ
ГОСТ 4204-77 (СТ СЭВ 3856-82)
КВАЛИФИКАЦИЯ (МАРКА, СОРТ)
Чистая для анализа
КОД ТН ВЭД
2807 00 000 1
УПАКОВКА
Химически чистую кислоту упаковывают в кварцевые или стеклянные ёмкости в зависимости от марки кислоты.
Техническую серную кислоту 1-го и 2-го сортов, башенную и регенерированную кислоты транспортируют в железнодорожных сернокислотных цистернах, а также в стальных контейнерах, стальных бочках по ГОСТ 6247 или поставляют потребителю перекачкой по кислотопроводу из стали марки Ст3 по ГОСТ 380.
В качестве транспортной тары особо чистой кислоты используют обрешётки из полимерных материалов.
Аккумуляторную кислоту транспортируют в ж/д цистернах, предназначенных для H2SO4, а также в стеклянных бутылках. Допускается перевозка автотранспортом.
Марка К транспортируется в цистернах из кислостойкой стали СтЗ с установкой фторопластовой прокладки или другого коррозиестойкого материала по отношению к кислоте.
КЛАСС ОПАСНОСТИ ГРУЗА ПО ДОПОГ(ООН)
8
ХИМИЧЕСКИЕ СВОЙСТВА
Серная кислота в чистом виде (формула H2SO4), при концентрации 100% представляет собой бесцветную густую жидкость. Самое важное свойство H2SO4 заключается в высокой гигроскопичности – это способность отнимать из воздуха воду. Данный процесс сопровождается масштабным выделением тепла.
H2SO4 – это сильная кислота.
Серная кислота называется моногидратом – в ней на 1 моль SO3 приходится 1 моль Н2О (воды). Из-за ее внушительных гигроскопических свойств ее используют для извлечения влаги из газов.
Температура кипения – 330 °С. При этом происходит разложение кислоты на SO3 и воду. Плотность – 1,84. Температура плавления – 10,3 °С/.
Концентрированная серная кислота представляет собой мощный окислитель. Чтобы запустить окислительно-восстановительную реакцию кислоту требуется нагреть. Итог реакции – SO2. S+2H2SO4=3SO2+2H2O
В зависимости от концентрации серная кислота по-разному вступает в реакцию с металлами. В разбавленном состоянии серная кислота способна окислять все металлы, которые стоят в ряду напряжений до водорода. Исключение составляют платина и золото как самые стойкие к окислению. Разбавленная серная кислота взаимодействует с солями, основаниями, амфотерными и основными оксидами. Серная кислота концентрированная способна окислять все металлы, стоящие в ряду напряжений, причем серебро тоже.
Серная кислота образует два вида солей: кислые (это гидросульфаты) и средние (сульфаты)
H2SO4 вступает в активную реакцию с органическими веществами и неметаллами, причем некоторые из них она способна превратить в уголь.
Серный ангидрит отлично растворяется в H2SО4, и при этом образуется олеум – раствор SО3 в серной кислоте. Внешне это выглядит так: дымящаяся серная кислота, выделяющая серный ангидрит.
Серная кислота в водных растворах является сильной двухосновной, и при добавлении ее к воде выделяется огромное количество теплоты. Когда готовят разбавленные растворы H2SО4 из концентрированных, необходимо небольшой струйкой добавлять более тяжелую кислоту к воде, а не наоборот. Это делается во избежание вскипания воды и разбрызгивания кислоты.
ПРИМЕНЕНИЕ
Техническая серная кислота предназначается для производства удобрений, искусственного волокна, капролактама, двуокиси титана, этилового спирта, анилиновых красителей и целого ряда других производств.
Серную кислоту применяют:
- в производстве минеральных удобрений;
- как электролит в свинцовых аккумуляторах;
- для получения различных минеральных кислот и солей;
- в производстве химических волокон, красителей, дымообразующих веществ и взрывчатых веществ;
- в нефтяной, металлообрабатывающей, текстильной, кожевенной и др. отраслях промышленности;
- в пищевой промышленности – зарегистрирована в качестве пищевой добавки E513 (эмульгатор);
- в промышленном органическом синтезе в реакциях: дегидратации (получение диэтилового эфира, сложных эфиров);
- гидратации (этанол из этилена);
- сульфирования (синтетические моющие средства и промежуточные продукты в производстве красителей);
- алкилирования (получение изооктана, полиэтиленгликоля, капролактама) и др.
Химически чистая кислота применяется для производства продукции специальной и тонкой химии.
Особо чистая кислота применяется для производства высокотехнологичных продуктов и аналитических материалов.
Аккумуляторная кислота применяется для производства электролита в свинцовых аккумуляторных батареях.
Марка К применяется для производства продукции промышленной и специальной химии.
УСЛОВИЯ ПОСТАВКИ
Продажа оптом с доставкой по всей России
Уточнить стоимость
Серная кислота Ч
МЕЖДУНАРОДНОЕ НАЗВАНИЕSulfuric acid
СИНОНИМЫ НАЗВАНИЙ
Купоросное масло
ВНЕШНИЙ ВИД
Серная кислота – маслянистая жидкость. Она бесцветна и тяжела, отличается крайней гигроскопичностью.
ФОРМУЛА
H₂SO₄
ГОСТ, ТУ
ГОСТ 14262-78
КВАЛИФИКАЦИЯ (МАРКА, СОРТ)
Техническая, Химически чистая, Особо чистая, Аккумуляторная, Марка К
КОД ТН ВЭД
2807 00 000 1
УПАКОВКА
Химически чистую кислоту упаковывают в кварцевые или стеклянные ёмкости в зависимости от марки кислоты.
Техническую серную кислоту 1-го и 2-го сортов, башенную и регенерированную кислоты транспортируют в железнодорожных сернокислотных цистернах, а также в стальных контейнерах, стальных бочках по ГОСТ 6247 или поставляют потребителю перекачкой по кислотопроводу из стали марки Ст3 по ГОСТ 380.
В качестве транспортной тары особо чистой кислоты используют обрешётки из полимерных материалов.
Аккумуляторную кислоту транспортируют в ж/д цистернах, предназначенных для H2SO4, а также в стеклянных бутылках. Допускается перевозка автотранспортом.
Марка К транспортируется в цистернах из кислостойкой стали СтЗ с установкой фторопластовой прокладки или другого коррозиестойкого материала по отношению к кислоте.
КЛАСС ОПАСНОСТИ ГРУЗА ПО ДОПОГ(ООН)
8
ХИМИЧЕСКИЕ СВОЙСТВА
Серная кислота в чистом виде (формула H2SO4), при концентрации 100% представляет собой бесцветную густую жидкость. Самое важное свойство H2SO4 заключается в высокой гигроскопичности – это способность отнимать из воздуха воду. Данный процесс сопровождается масштабным выделением тепла.
H2SO4 – это сильная кислота.
Серная кислота называется моногидратом – в ней на 1 моль SO3 приходится 1 моль Н2О (воды). Из-за ее внушительных гигроскопических свойств ее используют для извлечения влаги из газов.
Температура кипения – 330 °С. При этом происходит разложение кислоты на SO3 и воду. Плотность – 1,84. Температура плавления – 10,3 °С/.
Концентрированная серная кислота представляет собой мощный окислитель. Чтобы запустить окислительно-восстановительную реакцию кислоту требуется нагреть. Итог реакции – SO2. S+2H2SO4=3SO2+2H2O
В зависимости от концентрации серная кислота по-разному вступает в реакцию с металлами. В разбавленном состоянии серная кислота способна окислять все металлы, которые стоят в ряду напряжений до водорода. Исключение составляют платина и золото как самые стойкие к окислению. Разбавленная серная кислота взаимодействует с солями, основаниями, амфотерными и основными оксидами. Серная кислота концентрированная способна окислять все металлы, стоящие в ряду напряжений, причем серебро тоже.
Серная кислота образует два вида солей: кислые (это гидросульфаты) и средние (сульфаты)
H2SO4 вступает в активную реакцию с органическими веществами и неметаллами, причем некоторые из них она способна превратить в уголь.
Серный ангидрит отлично растворяется в H2SО4, и при этом образуется олеум – раствор SО3 в серной кислоте. Внешне это выглядит так: дымящаяся серная кислота, выделяющая серный ангидрит.
Серная кислота в водных растворах является сильной двухосновной, и при добавлении ее к воде выделяется огромное количество теплоты. Когда готовят разбавленные растворы H2SО4 из концентрированных, необходимо небольшой струйкой добавлять более тяжелую кислоту к воде, а не наоборот. Это делается во избежание вскипания воды и разбрызгивания кислоты.
ПРИМЕНЕНИЕ
Техническая серная кислота предназначается для производства удобрений, искусственного волокна, капролактама, двуокиси титана, этилового спирта, анилиновых красителей и целого ряда других производств.
Серную кислоту применяют:
- в производстве минеральных удобрений;
- как электролит в свинцовых аккумуляторах;
- для получения различных минеральных кислот и солей;
- в производстве химических волокон, красителей, дымообразующих веществ и взрывчатых веществ;
- в нефтяной, металлообрабатывающей, текстильной, кожевенной и др. отраслях промышленности;
- в пищевой промышленности – зарегистрирована в качестве пищевой добавки E513 (эмульгатор);
- в промышленном органическом синтезе в реакциях: дегидратации (получение диэтилового эфира, сложных эфиров);
- гидратации (этанол из этилена);
- сульфирования (синтетические моющие средства и промежуточные продукты в производстве красителей);
- алкилирования (получение изооктана, полиэтиленгликоля, капролактама) и др.
Химически чистая кислота применяется для производства продукции специальной и тонкой химии.
Особо чистая кислота применяется для производства высокотехнологичных продуктов и аналитических материалов.
Аккумуляторная кислота применяется для производства электролита в свинцовых аккумуляторных батареях.
Марка К применяется для производства продукции промышленной и специальной химии.
УСЛОВИЯ ПОСТАВКИ
Продажа оптом с доставкой по всей России
Уточнить стоимость
Доставляем в такие города, как:
Москва, Санкт-Петербург, Казань, Архангельск, Астрахань, Белгород, Барнаул, Бийск, Биробиджан, Братск,Брянск, Владивосток, Владимир, Вологда, Волгоград, Воронеж, Дзержинск, Иваново, Ижевск, Иркутск, Йошкар-Ола, Калининград, Калуга, Кемерово, Киров, Краснодар, Красноярск, Комсомольск-На-Амуре, Курган, Курск, Липецк, Магнитогорск,Мурманск, Набережные Челны, Нижний Новгород, Новороссийск, Новосибирск, Новый Уренгой, Омск, Оренбург, Орел, Пенза, Псков, Ростов-На-Дону, Пермь, Рязань, Самара, Саранск, Смоленск, Сыктывкар, Тамбов, Тверь, Тольятти, Томск, Тула, Тюмень, Улан-Удэ, Ульяновск, Уфа, Хабаровск, Чебоксары, Челябинск, Череповец, Чита, Сургут, Южно-Сахалинск, Ярославль и остальные города Российской Федерации.
Возможно, Вы искали:
концентрированная серная кислота, 3 серная кислота, серная кислота химическая, производство серной кислоты, серная кислота оптом, серная кислота купить оптом, серная кислота оптом цена, купить кислота серная техническая опт, серная кислота купить оптом с завода, производство серной кислоты


